中国注册
Chinese Registration
经典案例
Classic Case
II类注册
- Categories:国产
- Time of issue:2021-04-07 13:49:51
- Views:0
医疗器械注册是食品药品监督管理部门根据医疗器械注册申请人的申请,依照法定程序,对其拟上市医疗器械的安全性、有效性研究及其结果进行系统评价,以决定是否同意其申请的过程。
Ⅱ类是具有中度风险,需要严格控制管理以保证其安全、有效的医疗器械,境内生产企业需要在所在地省(直辖市)药监局进行注册,境外医疗器械生产企业需要委托境内代理人在NMPA进行注册。
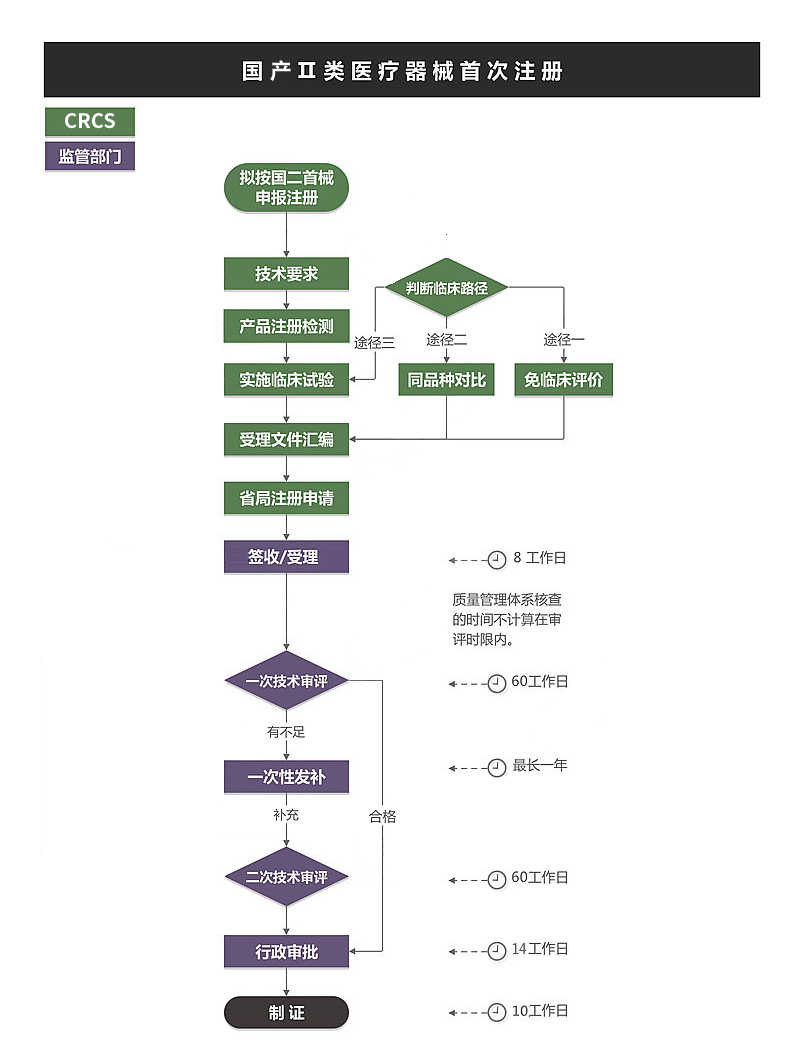
➣ 文件要求:
申请表;
证明性文件;
医疗器械安全有效基本要求清单;
综述资料;
研究资料;
生产制造信息;
临床评价资料;
产品风险分析资料;
产品技术要求
产品注册检验报告;
说明书和标签样稿;
符合性声明。
➣ NMPA收费情况
|
医疗器械产品注册费标准 |
||
|
单位:万元 |
||
|
项目分类 |
境内 |
|
|
第II类 |
首次注册费 |
由省级价格、财政部门制定 |
|
变更注册费 |
由省级价格、财政部门制定 |
|
|
延续注册费(五年一次) |
由省级价格、财政部门制定 |
|
注:
1.医疗器械产品注册收费按《医疗器械注册管理办法》、《体外诊断试剂注册管理办法》确定的注册单元计收。
2.《医疗器械注册管理办法》、《体外诊断试剂注册管理办法》中属于备案的登记事项变更申请,不收取变更注册申请费。
3. 港、澳、台医疗器械产品注册收费标准按进口医疗器械产品注册收费标准执行。
4. 医疗器械产品注册加急费收费标准另行制定。
➣ 时间分布
1. 立项阶段
预算、合同、考虑期,1个月。
2. 受理前资料准备
考虑检测平均消耗6个月,视产品情况有所变化。
临床试验不可与检测并行,临床应单独核算时间,预算至少应按12个月计。
如需精算请联络CRCS。(免临床目录产品除外。)
注册资料编制可与检测或临床并行。
3. 受理后
NMPA法定消耗预算10个月。(188工日,20工日/月,不计节假)
发补时限0~12个月,考虑平均时间6个月。视产品首次申报资料情况而定。
体系考核:根据法规,目前存在NMPA到境外生产当地飞行检查的可能性。
4. 预算合计
无临床试验国产II类医疗器械首次注册,预算应至少16~24个月。
有临床试验国产II类医疗器械首次注册,预算应至少36个月。(其中临床至少计12个月。)
Scan the QR code to read on your phone

- 微信公众号 -
- 邮箱
- 电话 8610-63323201
- 返回
联系方式
北京迈迪克豪尔医药技术咨询服务有限公司


