中国注册
Chinese Registration
全部分类
经典案例
Classic Case
创新IVD产品特别审批
- Categories:其他
- Time of issue:2021-04-08 13:57:30
- Views:0
Description:
Information
国家食品药品监督管理部门对同时符合下列情形的IVD产品优先进行技术审评审批:
(一)申请人经过其技术创新活动,在中国依法拥有产品核心技术发明专利权,或者依法通过受让取得在中国发明专利权或其使用权;或者核心技术发明专利的申请已由国务院专利行政部门公开。
(二)产品主要工作原理/作用机理为国内首创,产品性能或者安全性与同类产品比较有根本性改进,技术上处于国际领先水平,并且具有显著的临床应用价值。
(三)申请人已完成产品的前期研究并具有基本定型产品,研究过程真实和受控,研究数据完整和可溯源。
➣ 服务流程
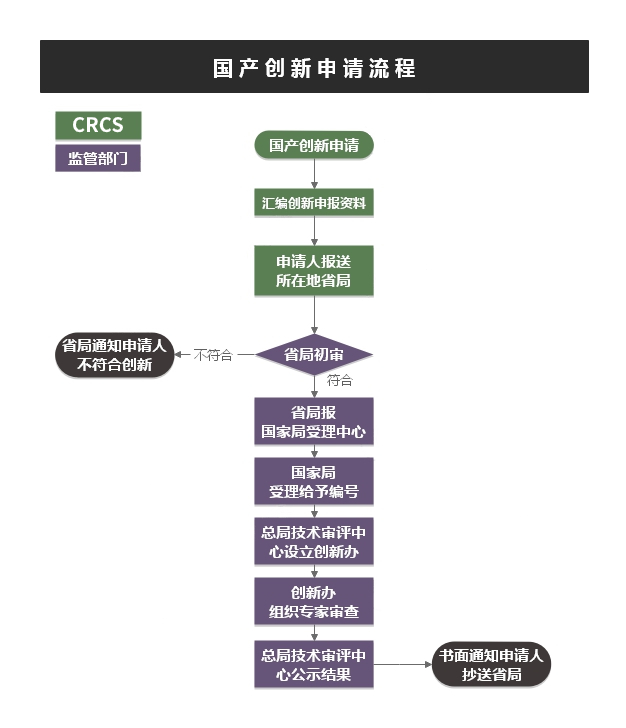
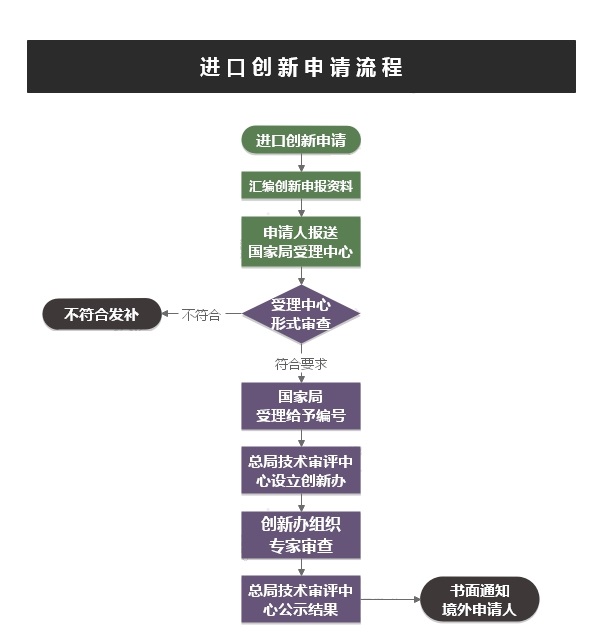
➣ 文件要求:
1. 申请表;
2. 申请人企业法人资格证明文件;
3. 产品知识产权情况及证明文件;
4. 产品研发过程及结果的综述;
5. 产品技术文件;
6. 产品创新的证明性文件;
7. 产品安全风险管理报告;
8. 产品说明书(样稿);
9. 其他证明产品符合本程序第二条的资料。
➣ NMPA收费情况:
创新IVD特别审批申请NMPA不收费。批准或未批准创新批件,不影响III类、II类产品首次注册收费和正常申报。
➣ 时间分布:
理论时间为60个工作日。
Scan the QR code to read on your phone

- 微信公众号 -
- 邮箱
- 电话 8610-63323201
- 返回
联系方式
北京迈迪克豪尔医药技术咨询服务有限公司


