海外认证
Overseas Certification
全部分类
经典案例
Classic Case
MDR申请流程
- 分类:欧盟CE
- 发布时间:2021-04-08 17:17:58
- 访问量:0
概要:
详情
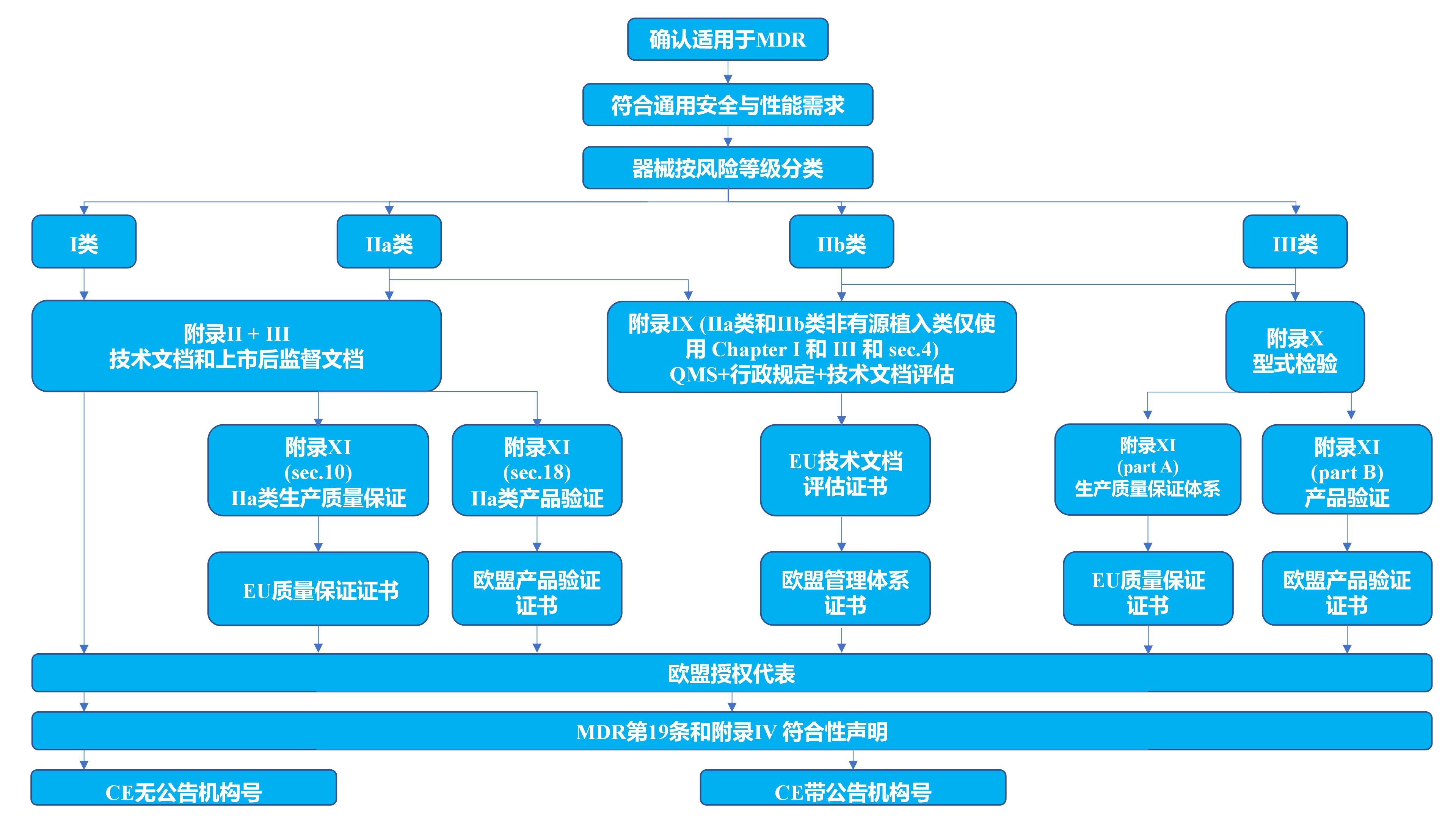
普通医疗器械CE认证的一般步骤:
步骤1. 分析该器械的特点,确定它所属的法规
步骤2. 确定该器械的分类(风险分级)
步骤3. 选择相应的符合性评价程序
步骤4. 选择公告机构
步骤5. 确认适用的基本要求/有关的协调标准
步骤6. 确认该器械满足基本要求/协调标准, 并使证据文件化
步骤7. 欧盟授权代表。
步骤8. 欧洲注册。
步骤9. 对于需要公告机构评审的器械,通过公告机构的符合性程序
步骤10. 起草符合性声明并加贴CE标志
根据多年的法规实践,建议将技术文件分为两部分:
A部分(概要):
1.制造商信息:名称、地址、生产场地
2.产品名称、分类
3.公告机构的信息以及合格评估路径
4.符合性声明
5.产品基本介绍:预期用途、规格型号、附件等
6.标签、使用说明书及语言的要求
7.基本要求检查表
8.风险分析和控制的概述
9.产品符合的法规和标准
10.产品验证和确认的概述
11.临床评价报告
B部分:其余技术相关内容,如:
1.产品详细信息
2.基本要求的支持性证据
3.测试报告
4.临床数据
5.风险管理文档
6.过程确认
7.制造、检验的文件
8.应用的标准
扫二维码用手机看

- 微信公众号 -
- 邮箱
- 电话 8610-63323201
- 返回
联系方式
北京迈迪克豪尔医药技术咨询服务有限公司


