医疗器械临床评价报告
- 分类:临床评价报告撰写服务
- 发布时间:2021-03-25 14:57:58
- 访问量:0
一、临床评价报告的定义
根据《医疗器械监督管理条例》和《医疗器械注册管理办法》以及医疗器械临床试验质量管理相关的规定,医疗器械临床评价是指注册申请人通过临床文献资料、临床经验数据、临床试验等信息对产品是否满足使用要求或者适用范围进行确认的过程。
二、临床评价报告的适用范围
1.医疗器械临床评价指导原则适用于第II类、第III类医疗器械注册申报时的临床评价工作,并不适用于按医疗器械管理的体外诊断试剂的临床评价工作;
2.如有针对特定产品的临床评价技术指导原则发布,则相应产品临床评价工作应遵循有关要求。
三、临床评价报告的基本原则
1.临床评价应全面、客观,应通过临床试验等多种手段收集相应数据,临床评价过程中收集的临床性能和安全性数据、有利的和不利的数据均应纳入分析。临床评价的深度和广度、需要的数据类型和数据量应与产品的设计特征、关键技术、适用范围和风险程度相适应,也应与非临床研究的水平和程度相适应;
2.临床评价应对产品的适用范围(如适用人群、适用部位、与人体接触方式、适应症、疾病的程度和阶段、使用要求、使用环境等)、使用方法、禁忌症、防范措施、警告等临床使用信息进行确认;
3.注册申请人通过临床评价应得出以下结论:在正常使用条件下,产品可达到预期性能;与预期受益相比较,产品的风险可接受;产品的临床性能和安全性均有适当的证据支持。
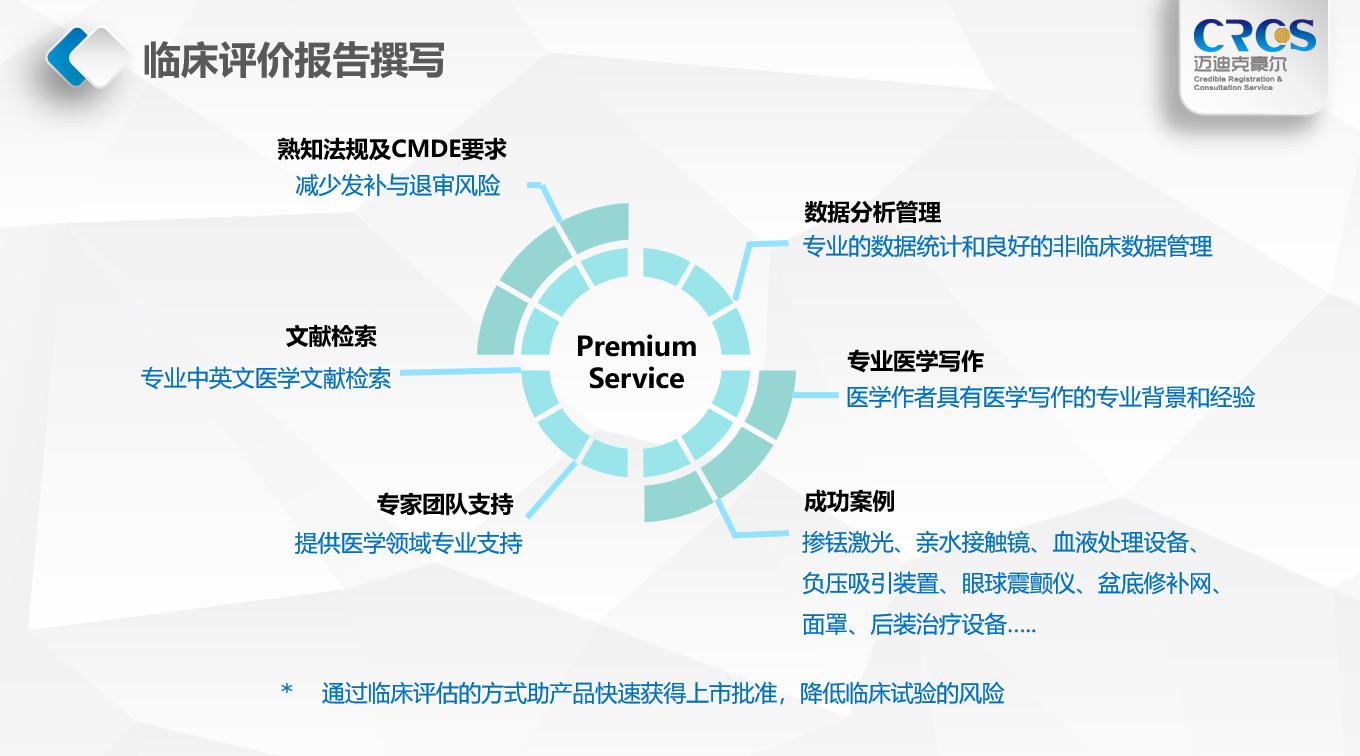
四、CRCS的相关服务
医疗器械临床评价报告编写是一个复杂的过程,需要不断的与NMPA沟通,同时需要企业与CRCS之间的通力配合,才能保证最终报告的圆满完成。
临床撰写服务是CRCS的精品服务之一。我们不仅为在中国进行临床试验和注册等相关工作的客户提供临床文档撰写服务,同时也为准备进入中国市场的国外及港澳台客户在注册过程中提供专业的临床试验以外的支持。CRCS撰写服务涵盖了临床评价、临床试验方案、临床试验报告、医学报告等各类医学文档的撰写服务。
注册申报经验和临床试验经验的基础就是我们临床撰写工作的有力支持。我们医学写作组的员工拥有丰富的临床撰写经验,也包括大量NMPA新法规实施后的临床撰写经验。CRCS期待为您的申报与研究提供向导。
五、CRCS的独特优势
扫二维码用手机看

- 微信公众号 -
- 邮箱
- 电话 8610-63323201
- 返回
联系方式
北京迈迪克豪尔医药技术咨询服务有限公司


