有源医疗器械
2021-03-25
中国注册
Chinese Registration
经典案例
Classic Case
医疗器械备案是医疗器械备案人向食品药品监督管理部门提交备案资料,食品药品监督管理部门对提交的备案资料存档备查。
Ⅰ类是风险程度低,实行常规管理可以保证其安全、有效的医疗器械,境内生产企业需要在所在地市药监局进行备案,境外医疗器械生产企业需要委托境内代理人在NMPA进行备案。
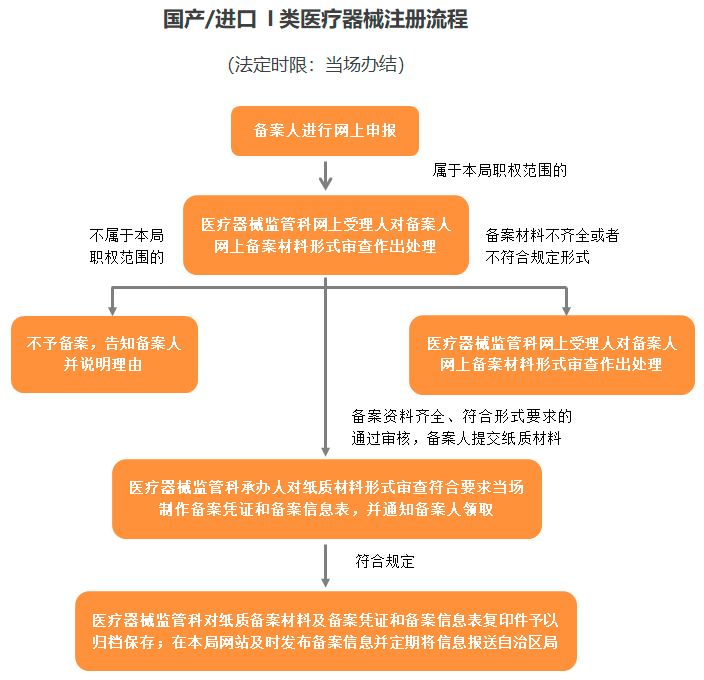
➣ 文件要求:
第I类医疗器械备案表;
安全风险分析报告;
产品技术要求;
产品检验报告;
临床评价资料;
产品说明书及最小销售单元标签设计样稿;
生产制造信息;
证明性文件;
符合性声明;
与产品研制、生产有关的质量管理体系文件。
➣ NMPA费用:无
➣ 时间分布:当场受理
Scan the QR code to read on your phone

- 微信公众号 -
联系方式
北京迈迪克豪尔医药技术咨询服务有限公司