接受境外临床数据
- 分类:接受境外临床数据
- 发布时间:2021-03-25 15:13:25
- 访问量:0
一、境外临床试验数据的适用范围
根据《接受医疗器械境外临床试验数据技术指导原则》,医疗器械(含IVD产品)在中国申报注册时,接受申请人采用境外临床试验数据作为临床评价资料的工作。
二、境外临床试验数据的提交情况及接受要求
1.申请人提交的境外临床试验资料应至少包括:临床试验方案、伦理意见、临床试验报告。临床试验报告应包含对完整临床试验数据的分析及结论。
2.根据我国注册相关技术要求还需补充部分资料时,可在我国境内或境外开展补充临床试验,其补充试验数据与原境外试验数据综合评价后符合我国注册相关技术要求后,予以接受。
三、接受境外临床试验资料时的考虑因素及技术要求
1.技术审评要求和差异
a)境外进行的临床试验可能符合试验开展所在国家(地区)的技术审评要求,但不一定完全符合我国相关审评要求。当存在此类差异时,需提供能够证明医疗器械的安全性有效性达到标准的证据支持。
2.受试人群差异
a)内在因素:指基于人类遗传学特征或人口学特征的影响因素,包括人种、种族、年龄、性别等方面。
b)外在因素:指基于社会环境、自然环境、文化的影响因素,包括饮食习惯、宗教信仰、所暴露环境、吸烟、饮酒、疾病发生率、罕见或地域性共病、肥胖、治疗理念、社会经济情况、教育程度、医疗依从性等方面。
c)上述的部分因素同时可基于内在和外在因素而产生,例如种族差异。
3.临床试验条件差异
a)境外临床试验需考虑与我国试验条件的差异对试验数据及我国预期使用人群的相关性产生的影响。试验条件差异包括:医疗环境、医疗设施、研究者能力(学习曲线)、诊疗理念或准则的差异等。有些因素可能对试验结果产生显著的影响,例如由于诊疗理念或标准不同,临床操作方法可能不符合我国相关临床操作指南。
b)对于能够明确界定的对试验数据产生有临床意义影响的因素,申请人可针对差异因素在我国境内进行补充试验,结合原有的境外临床试验数据共同用于确认该器械在我国正常使用条件下的安全有效性。
c)建议申请人在提交境外临床试验数据前,与医疗器械审评部门进行充分沟通,以利于对拟申报医疗器械临床评价资料的科学、完整、充分达成共识。
四、使用境外临床试验数据情况下,不同临床评价路径的情况
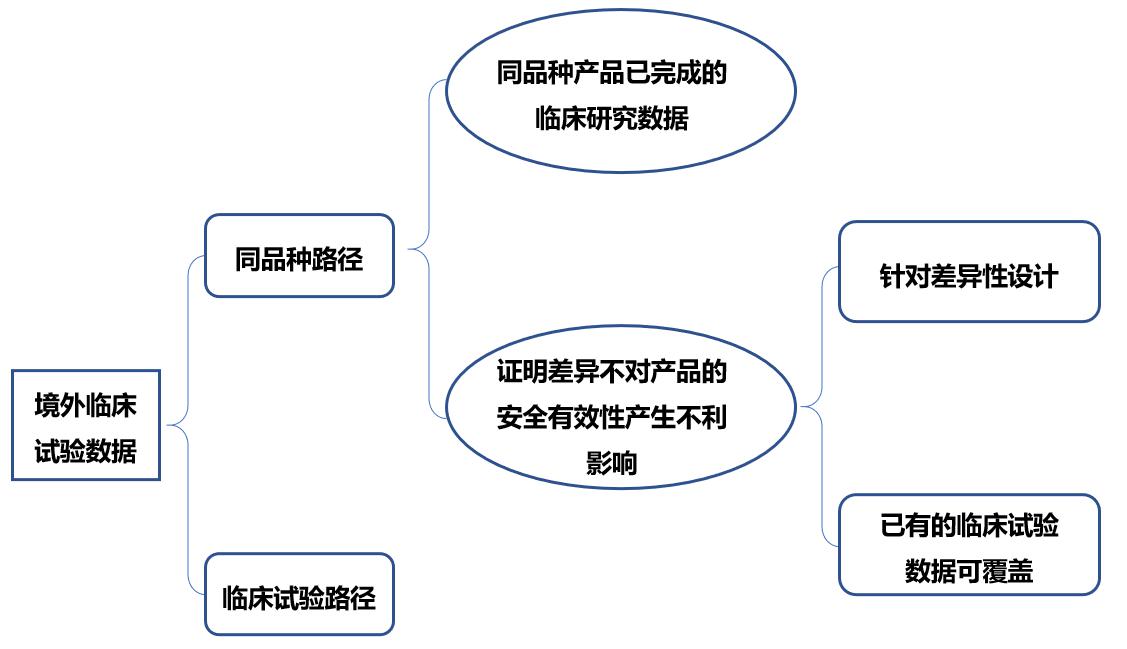
CRCS的临床部联合注册部,共同审阅客户提供的境外临床数据。通过对比境内外临床试验标准,详细阅读试验设计以及医疗器械识别与使用信息等数据,评估境外临床数据在中国标准下的准确性与完整性。针对每一位客户的不同情况量身定制临床评价报告与注册方案。
扫二维码用手机看

- 微信公众号 -
- 邮箱
- 电话 8610-63323201
- 返回
联系方式
北京迈迪克豪尔医药技术咨询服务有限公司


