有源医疗器械
2021-03-25
中国注册
Chinese Registration
经典案例
Classic Case
国家食品药品监督管理部门对同时符合下列情形的医疗器械优先进行技术审评审批:
(一)申请人经过其技术创新活动,在中国依法拥有产品核心技术发明专利权,或者依法通过受让取得在中国发明专利权或其使用权;或者核心技术发明专利的申请已由国务院专利行政部门公开。
(二)产品主要工作原理/作用机理为国内首创,产品性能或者安全性与同类产品比较有根本性改进,技术上处于国际领先水平,并且具有显著的临床应用价值。
(三)申请人已完成产品的前期研究并具有基本定型产品,研究过程真实和受控,研究数据完整和可溯源。
➣ 服务流程
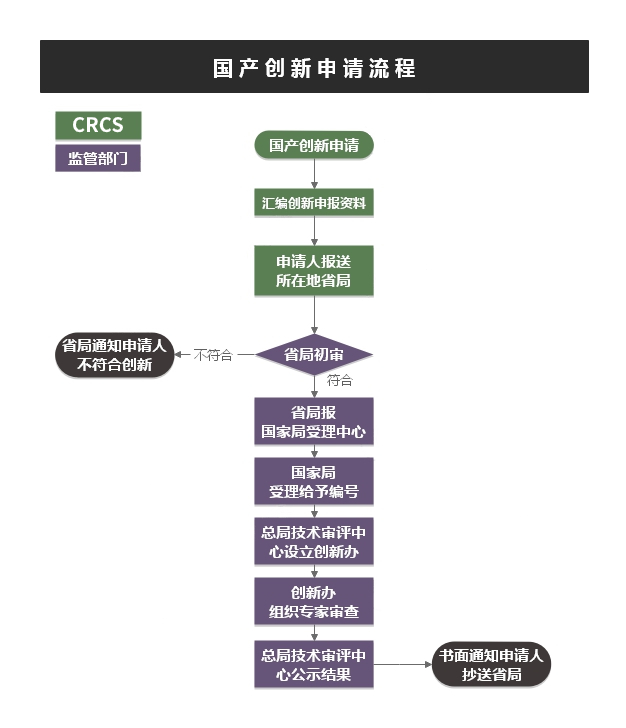
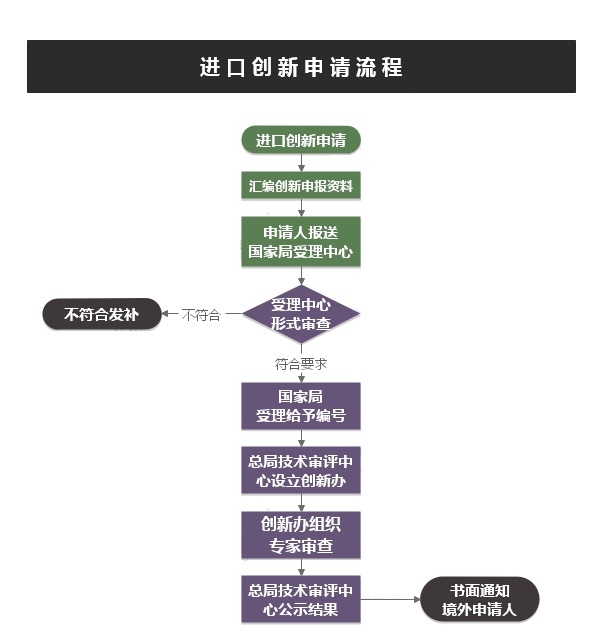
➣ NMPA收费情况:
创新医疗器械特别审批申请NMPA不收费。批准或未批准创新批件,不影响III类、II类产品首次注册收费和正常申报。
➣ 时间分布:
理论时间为60个工作日。
Scan the QR code to read on your phone

- 微信公众号 -
联系方式
北京迈迪克豪尔医药技术咨询服务有限公司