中国注册
Chinese Registration
全部分类
经典案例
Classic Case
I类备案
- Categories:国产
- Time of issue:2021-04-07 15:26:45
- Views:0
Description:
Information
《体外诊断试剂注册管理办法》所称的体外诊断试剂,是指按医疗器械管理的体外诊断试剂,包括在疾病的预测、预防、诊断、治疗监测、预后观察和健康状态评价的过程中,用于人体样本体外检测的试剂、试剂盒、校准品、质控品等产品。可以单独使用,也可以与仪器、器具、设备或者系统组合使用。
体外诊断试剂的分类按检测原理或检测方法分类主要有生化诊断试剂、免疫诊断试剂,分子诊断试剂、微生物诊断试剂、尿液诊断试剂、凝血类诊断试剂、血液学和流式细胞诊断试剂等,其中生化、免疫、分子诊断试剂为我国诊断试剂主要的三大类品种。
按照药品管理的用于血源筛查的体外诊断试剂和采用放射性核素标记的体外诊断试剂,不属于《体外诊断试剂注册管理办法》的管理范围。
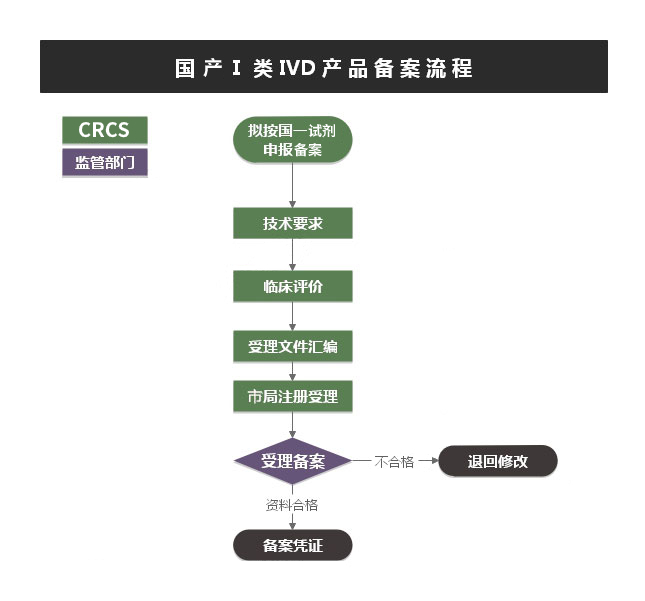
➣ 文件要求:
1. 第I类IVD产品备案申请表;
2. 安全风险分析报告;
3. 产品技术要求;
4. 产品检验报告;
5. 临床评价资料;
6. 产品说明书及最小销售单元标签设计样稿;
7. 生产制造信息;
8. 证明性文件;
9. 符合性声明;
10. 与产品研制、生产有关的质量管理体系文件。
➣ NMPA费用:无
➣ 时间分布:当场受理
Scan the QR code to read on your phone

- 微信公众号 -
- 邮箱
- 电话 8610-63323201
- 返回
联系方式
北京迈迪克豪尔医药技术咨询服务有限公司


