海外认证
Overseas Certification
全部分类
经典案例
Classic Case
I类医疗器械产品列名
- 分类:美国FDA
- 发布时间:2021-04-08 17:35:02
- 访问量:0
概要:
详情
目前FDA医疗器械产品目录中共有超1,800种产品,对Ⅰ类产品(占47%左右),实行的是普通控制 (General Control)①,绝大部分产品在进行企业注册 (Facility Registration)②、产品列名 (Product Listing)③ 和实施GMP规范后,产品即可进入美国市场【其中极少数产品连GMP也豁免;极少数保留产品需向FDA 递交上市前通知(PMN,Premarket Notification),即510(k)】。
①一般控制包括以下内容:产品/标签标示、企业注册、器械列名登记、上市前通知(如有需要)、质量体系、标识、医疗器械报告(MDR)
②根据美国联邦法规21 CFR part 807章节的要求,涉及生产和分销用于在美国进行商业活动的医疗器械企业必须每年向FDA进行注册,注册的过程称之为企业注册。
③这些在美国进行商业活动的医疗器械企业必须向FDA确认他们进行商业分销的医疗器械,包括仅用于出口的器械,这个过程称为产品列名。
➣ CRCS的服务流程
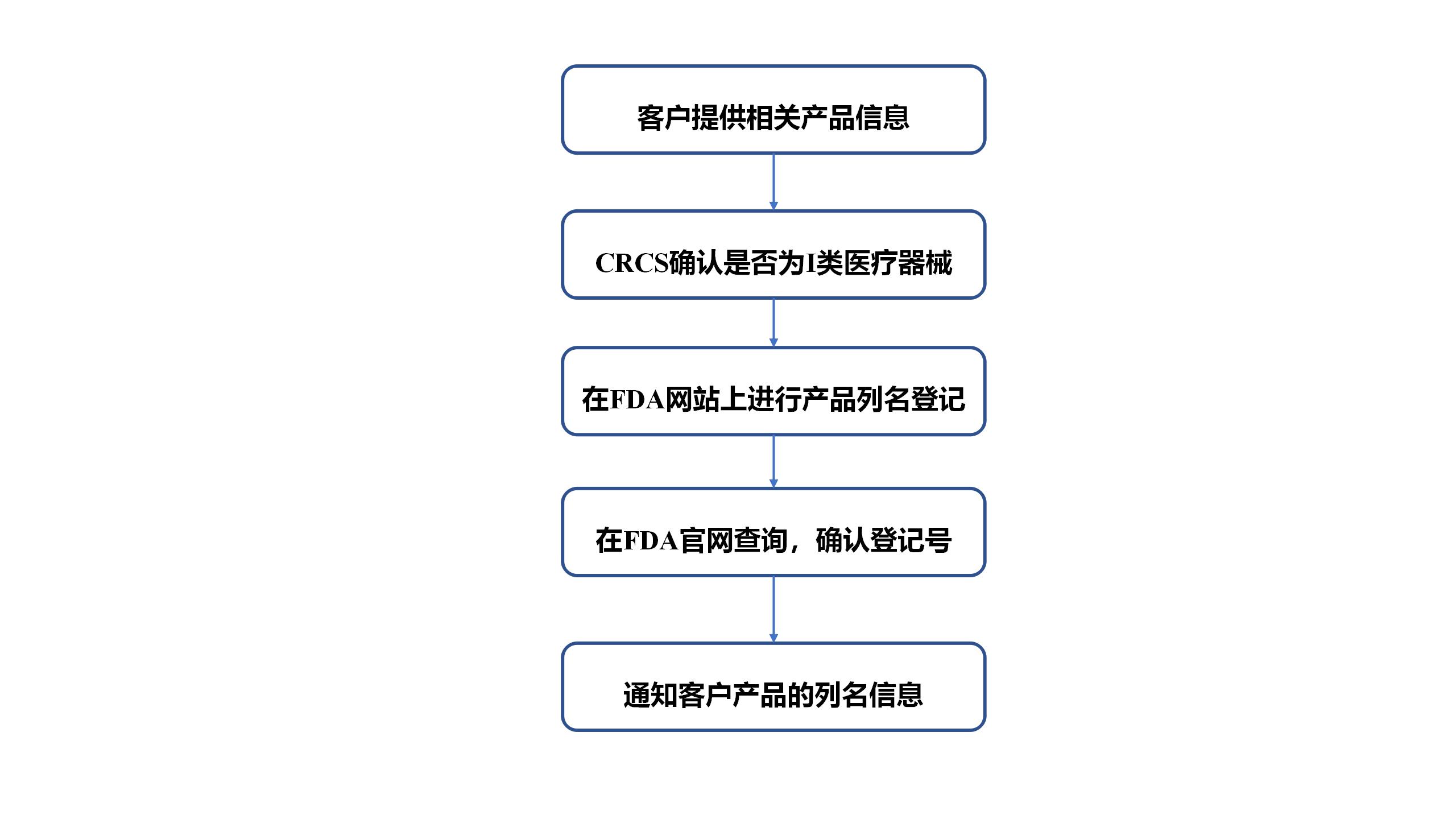
➣ FDA行政费:2021至2022财年的企业注册费为$5,546。每年的企业注册费会有改动,请及时关注FDA官网或随时联系CRCS进行咨询。
扫二维码用手机看

- 微信公众号 -
- 邮箱
- 电话 8610-63323201
- 返回
联系方式
北京迈迪克豪尔医药技术咨询服务有限公司


