前言
本指导原则旨在指导注册申请人对一氧化氮治疗仪注册申报资料的准备及撰写,同时也为技术审评部门审查注册申报资料提供参考。
本指导原则是对一氧化氮治疗仪的一般要求,申请人应依据产品的具体特性确定其中内容是否适用。若不适用,需具体阐述理由及相应的科学依据,并依据产品的具体特性对注册申报资料的内容进行充实和细化。
本指导原则是供注册申请人和技术审评人员使用的指导性文件,但不包括审评审批所涉及的行政事项,亦不作为法规强制执行,应在遵循相关法规的前提下使用本指导原则。如果有能够满足相关法规要求的其他方法,也可以采用,但是需要提供详细的研究资料和验证资料。
本指导原则是在现行法规和标准体系以及当前认知水平下制定,随着法规和标准的不断完善,以及科学技术的不断发展,相关内容也将适时进行调整。
适用范围
一氧化氮治疗仪向患者呼吸道输送浓度可控的一氧化氮气体,同时监测一氧化氮、二氧化氮、氧气浓度,提供相应的报警功能。某些产品具备气体发生器,用于产生一氧化氮。一氧化氮治疗仪一般与呼吸设备联合使用,也可以集成到呼吸设备,辅助治疗肺动脉高压症。
本指导原则适用于一氧化氮治疗仪,也适用于集成了一氧化氮治疗功能的呼吸设备。
注册审查要点
产品名称,建议使用通用名称:一氧化氮治疗仪。
管理类别和分类编码,产品按第三类医疗器械管理,分类编码为08-03。
注册单元划分,技术原理不同的产品划分为不同的注册单元。
具备一氧化氮发生器的产品不需要外接医用一氧化氮气体钢瓶,不具备一氧化氮发生器的产品需要外接医用一氧化氮气体钢瓶才能提供治疗。前述两种产品划分为不同的注册单元。
一氧化氮发生器有多种技术原理,一氧化氮气体可以通过电化学反应产生,也可以通过空气脉冲放电或其他原理产生。采用不同技术原理发生器的产品划分为不同的注册单元。
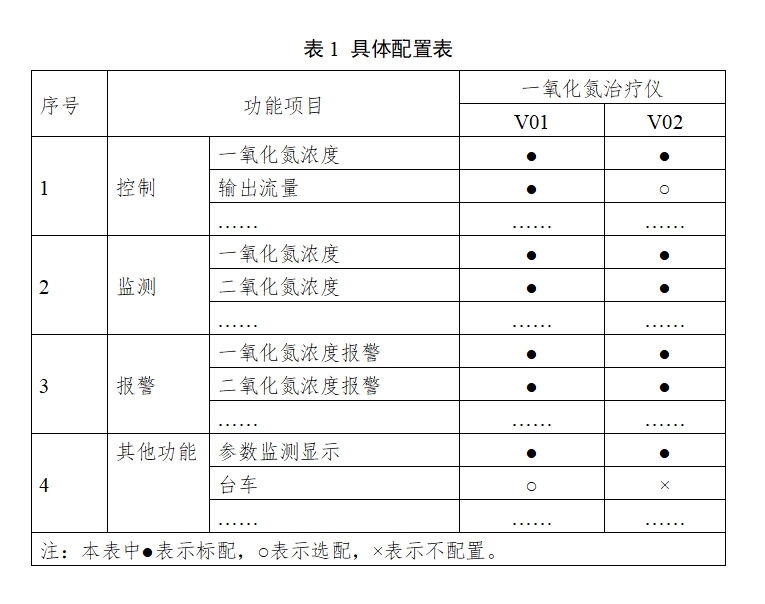
对于存在多种型号规格的产品,按照上述产品描述的要求,明确各型号规格的区别。采用对比表及带有说明性文字的图片、图表,对所有型号规格的结构组成(或配置)、功能、产品特征和运行模式、性能指标等方面进行描述。
例如,产品有V01和V02两个型号,型号规格说明举例如下:
表1 具体配置表
|
序号 |
功能项目 |
一氧化氮治疗仪 |
||
|
V01 |
V02 |
|||
|
1 |
控制 |
一氧化氮浓度 |
● |
● |
|
输出流量 |
● |
○ |
||
|
…… |
…… |
…… |
||
|
2 |
监测 |
一氧化氮浓度 |
● |
● |
|
二氧化氮浓度 |
● |
● |
||
|
…… |
…… |
…… |
||
|
3 |
报警 |
一氧化氮浓度报警 |
● |
● |
|
二氧化氮浓度报警 |
● |
● |
||
|
…… |
…… |
…… |
||
|
4 |
其他功能 |
参数监测显示 |
● |
● |
|
台车 |
○ |
× |
||
|
…… |
…… |
…… |
||
|
注:本表中●表示标配,○表示选配,×表示不配置。 |
||||
性能研究资料
根据申报产品适用范围和技术特征,提供非临床研究综述,逐项描述所开展的研究,概述研究方法和研究结论。根据非临床研究综述,提供相应的研究资料,各项研究可通过文献研究、实验室研究、模型研究等方式开展,一般应当包含研究方案、研究报告。采用建模研究的,应当提供产品建模研究资料。
软件研究
产品的软件属于软件组件,用来控制产品的运行,包括各项参数的控制、监测和报警,软件安全性级别归为严重。参照《医疗器械软件注册审查指导原则》(2022修订版)、《医疗器械网络安全注册审查指导原则》(2022修订版)的要求,提供研究资料。
生物学特性研究
申请人应说明产品预期与气体接触的部位,提交与气体接触的材料清单;说明使用的材料的基本信息,如材料的组成、成份信息、材料的物理和化学属性等,并应保证使用的材料的安全性。建议参照YY/T 1778.1系列标准,提交产品气体通路生物相容性研究资料。
临床评价资料
一氧化氮治疗仪一般可采取同品种对比的路径开展临床评价。与同品种产品在配合呼吸设备使用时输出的一氧化氮浓度、流量进行对比;具备一氧化氮气体发生器的产品,与医用一氧化氮气体或其他已批准同品种产品进行气体质量对比。
如果产品与同品种产品在配合呼吸设备使用时输出的一氧化氮浓度、流量差异较大,或申报产品具有其他特殊功能(如生理闭环控制等),考虑提交临床试验数据。
扫二维码用手机看
推荐新闻

- 微信公众号 -
- 邮箱
- 电话 8610-63323201
- 返回
联系方式
北京迈迪克豪尔医药技术咨询服务有限公司